AMINOÁCIDOS ESENCIALES EN LAS
PROTEÍNAS
Los aminoácidos son pequeñas moléculas orgánicas que contienen al menos un grupo amino (-NH2), de naturaleza básica, y un grupo carboxilo (-COOH) de carácter ácido además de una cadena variable (-R) y un hidrógeno (-H).
Los aminoácidos son pequeñas moléculas orgánicas que contienen al menos un grupo amino (-NH2), de naturaleza básica, y un grupo carboxilo (-COOH) de carácter ácido además de una cadena variable (-R) y un hidrógeno (-H).
|
NOMBRE DEL AMINOÁCIDO
|
INFORMACIÓN
|
FÓRMULA
ESTRUCTURAL
|
|
Serina (Ser,S)
|
La
serina es un aminoácido polar, pero no cargado a pH neutro. Su símbolo es S
en código de una letra y Ser en código de tres letras. Forma parte del centro
activo de muchas enzimas gracias a su grupo -OH. Es precursor de otros
aminoácidos y de esfingolípidos. Puede sufrir fosforilación y
O-glicosilación. La serina es un
aminoácido polar debido al grupo -OH, un grupo muy reactivo que hace que la
serina se encuentre en el centro activo de varias enzimas, como las
serinproteasas
|
 |
|
Treonina (Thr,T)
|
La
treonina es un aminoácido polar, no cargado a pH neutro. Su símbolo es T en
código de una letra y Thr en código de tres letras. Es un aminoácido
esencial. Sufre fosforilación y O-glicosilación. Su fosforilación es
importante en señalización intracelular. La treonina se fosforila por serin-treonin quinasas,
dando fosfotreonina.
|
 |
|
Cisteína (Cys,C)
|
La
cisteína es un aminoácido polar no cargado a pH neutro. Su símbolo es C en
código de una letra y Cys en código de tres letras Es un aminoácido con
azufre, al igual que la metionina, conteniendo un grupo tiol (-SH). A pH
ligeramente básico este grupo se oxida y dos cisteínas pueden unirse por
enlace disulfuro formándose la cistina. La cisteína también forma parte del
glutation. La cisteína puede formar enlaces disulfuro en proteínas, generando
estabilidad térmica en éstas. La cisteína es un aminoácido no cargado a pH
neutro pero se oxida su grupo tiol a pH ligeramente básico formándose la
cistina por unión de dos cisteínas.
|
 |
|
Asparagina (Asn,N)
|
Aminoácido que tiene por símbolo en el código de un solo
carácter a la letra N y en el sistema de tres letras Asn. La glicosilación de la asparragina es un fenómeno muy importante que sufren las proteínas destinadas al espacio extracelular. Un aminoácido
no esencial que interviene en el control metabólico de las funciones celulares en tejidos
nerviosos y cerebrales. Es biosintetizado por la asparagina sintetiza a partir del ácido aspártico y elamonio.
|
|
|
Glutamina (Gln,Q)
|
Es
un aminoácido, un bloque de construcción para las proteínas, que se encuentra
de forma natural en el cuerpo. La glutamina se utiliza para contrarrestar
algunos de los efectos secundarios de los tratamientos médicos como: se
utiliza para los efectos secundarios de la quimioterapia del cáncer,
incluyendo la diarrea, el dolor y la inflamación dentro de la boca, dolor
nervioso, dolores musculares y articulares causados por el
medicamento para el cáncer taxol.
|
|
|
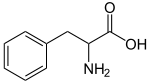
Tirosina (Tyr,Y)
|
Se clasifica como un aminoácido no esencial en los
mamíferos ya que su síntesis se produce a partir de la hidroxilación de otro
aminoácido: la fenilalanina. Esto se considera
así siempre y cuando la dieta de los mamíferos contenga un aporte adecuado de
fenilalanina siendo esencial. Está formado por un carbono central alfa (Cα) unido a un átomo de hidrógeno (-H), un grupo carboxilo
(-COOH), un grupo amino (-NH2) y una cadena lateral. En la tirosina,
la cadena lateral es un grupo fenólico.
|
|
|
Glicina (Gly,G)
|
En el
código genético está codificada
como GGU, GGC, GGA o GGG. Es el aminoácido más pequeño y el único no quiral presentes en la célula. Su fórmula
química es NH2CH2COOH y su masa es 75,07. La glicina actúa como neurotransmisor inhibidor en el sistema
nervioso central. Fue propuesta
como neurotransmisor en 1965.
|
 |
|
Alanina (Ala,A)
|
Es
codificada por los codones GCU,
GCC, GCA y GCG. Es el aminoácido más pequeño después de la glicina y se clasifica como hidrófobico. La
alanina es un aminoácido no esencial para el ser humano pero es de gran
importancia. Existe en dos distintos enantiómeros - L-alanina y D-alanina. La
L-alanina, más ampliamente usados en biosíntesis de proteína, detrás de la leucina,
encontrándose en un 7,8 % de las estructuras primarias, en una muestra
de 1.150 proteínas.
|
 |
|
Valina (Val,V)
|
Es uno de los veinte aminoácidos codificados por el ADN en la Tierra,
cuya fórmula química es HO2CCH(NH2)CH(CH3)2.
En el ARN mensajero, está codificada por GUA, GUG, GUU o GUC. Nutricionalmente, en humanos, es uno de los aminoácidos
esenciales. Forma parte integral
del tejido muscular, puede ser usado para conseguir energía por los músculos
en ejercitación, posibilita un balance de nitrógeno positivo e interviene en
el metabolismo muscular y en la reparación de tejidos.
|
 |
|
Leucina (Leu,L)
|
Utiliza las células para
sintetizar proteínas.
Está codificada en el ARN mensajero como UUA, UUG, CUU, CUC, CUA o CUG. Su cadena
lateral es no polar, un grupo isobutilo. Es uno de los aminoácidos
esenciales. Como un suplemento en
la dieta, se ha descubierto que la leucina reduce la degradación del tejido
muscular incrementando la síntesis de proteínas musculares en ratas viejas. La leucina se usa en el hígado,
tejido adiposo, y tejido muscular. En tejido adiposo y muscular, se usa para
la formación de esteroles,
y solo el uso en estos dos tejidos es cerca de siete veces mayor que el uso
en el hígado.
|
 |
|
Isoleucina (Ile,I)
|
Es uno de los aminoácidos naturales más comunes, Su composición física es
idéntica a la de la leucina,
pero la colocación de sus átomos es ligeramente diferente, dando lugar a
propiedades diferentes; su cadena lateral es no polar (por tanto
hidrofobica), un grupo sec-butilo
|
|
|
Metionina (Met,M)
|
Es un
aminoácido hidrófobo, cuya fórmula química es: HO2CCH(NH2)CH2CH2SCH3.
Al ser hidrófobo está clasificado como no polar.
Junto a la cisteína,
la metionina es uno de los dos aminoácidos proteinogénicos que contienen
azufre. Este deriva de la s-Adenosil
metionina (SAM) sirviendo
como donante de metilos. La metionina es un intermediario en la biosíntesis
de la cisteína, la carnitina, la taurina, la lecitina, la fosfatidilcolina y
otros fosfolípidos. Fallos en la conversión de metionina pueden desembocar en
ateroesclerosis.
|
 |
|
Prolina (Pro,P)
|
En el ARN mensajero está
codificada como CCU, CCC, CCA o CCG. Se trata del único aminoácido
proteinogénico cuya α-amina es una amina
secundaria en lugar de una amina primaria. La prolina en
realidad es un iminoácido, pues su cadena lateral
es cíclica y está compuesta por 3 unidades de metileno;
estos quedan unidos al carbono alfa y al grupo
amino, el cual pasa a llamarse imino. La prolina
se puede formar directamente a partir de la cadena pentacarbonada del ácido glutámico, y por tanto no es un aminoácido esencial. Es una molécula hidrófoba. Su masa molar es 115,13
g/mol. Es un aminoácido apolar y aromático.
|
 |
|
Fenilalanina (Phe,F)
|
La fenilalanina está
presente también en muchos psicoactivos.
Contiene un anillo bencénico, y es por tanto uno de los aminoácidos aromáticos. Su uso excesivo
produce efectos laxantes,
junto con la tirosina y el triptófano.
La L-fenilalanina se puede transformar, por medio de una reacción catalizada por la enzima fenilalanina
hidroxilasa, entirosina.
La L-fenilalanina es también el precursor de las catecolaminas como la L-dopa, la norepinefrina y la epinefrina,
a través de una etapa en la que se forma tirosina.
|
|
|
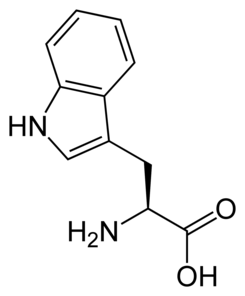
Triptófano (Trp,W)
|
Se clasifica entre los
aminoácidos apolares, también llamados hidrófobos.
Es esencial para promover la liberación del neurotransmisor serotonina,
involucrado en la regulación del sueño y
el placer. Su punto isoeléctrico se ubica a pH=5.89. La falta de
triptófano puede contribuir negativamente a cuadros de ansiedad, insomnio y estrés.
|
 |
|
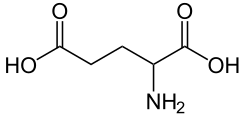
Ácido aspártico (Asp,D)
|
En el ARN se encuentra codificado por los codones GAU o GAC. Presenta un grupo carboxilo (-COOH) en el extremo de la cadena
lateral. Su fórmula química es HO2CCH(NH2)CH2CO2H. A pH fisiológico, tiene una carga
negativa (es ácido);
pertenece al grupo de aminoácidos con cadenas laterales polares cargadas. Su biosíntesis tiene lugar por transaminación del ácido
oxalacético, un metabolito intermediario del ciclo de Krebs.
|
|
|
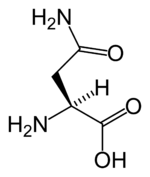
Ácido glutámico (Glu,E)
|
El ácido glutámico es crítico
para la función celular y no es nutriente esencial porque en el hombre puede
sintetizarse a partir de otros compuestos. Pertenece al grupo de los llamados
aminoácidos ácidos, o con carga negativa a pH fisiológico, debido a que presenta
un segundo grupo carboxilo en su cadena secundaria. Sus pK son
1,9; 3,1; 10,5 para sus grupos alfa-carboxilo, gamma-carboxilo y alfa-amino Es
el neurotransmisor excitatorio por excelencia de la corteza
cerebral humana. Su papel
como neurotransmisor está mediado por la estimulación de receptores
específicos, denominados receptores de glutamato, que se clasifican
en: ionotrópicos (canales iónicos) y receptores metabotrópicos (de siete dominios transmembrana y
acoplados a proteínas
G) de ácido glutámico.
|
|
|
Lisina (Lys,K)
|
Actúa químicamente
como una base, al igual que la arginina y la histidina,
ya que su cadena lateral contiene un grupo amino protonable que a menudo
participa en puentes
de hidrógeno y
como base general en catálisis.
Como aminoácido esencial, la lisina no se sintetiza en el organismo de los
animales y, por consiguiente, éstos deben ingerirlo como lisina o como
proteínas que contengan lisina.
|
|
|
Arginina (Arg,R)
|
En el tejido hepático,
la arginina puede ser sintetizada en el ciclo de la ornitina (o ciclo de la urea). Este
aminoácido se encuentra involucrado en muchas de las actividades de las glándulas
endocrinas. Su cadena lateral está formada por
un grupo guanidino. La arginina es un aminoácido condicionalmente
esencial (se necesita en la
dieta solo bajo ciertas condiciones), y puede estimular la función inmunológica al aumentar el número de leucocitos. La arginina está
involucrada en la síntesis de creatina, poliaminas y
en el ADN.
|
|
|
Histidina (His,H)
|
No puede ser fabricado
por su propio organismo y debe ser ingerido en la dieta), mientras que
bacterias, hongos y plantas pueden sintetizarlo internamente. Se
abrevia como His o H. Su grupo funcional es un imidazol cargado positivamente. La histidina tiene un pKa de 6,5. Esto significa que, pequeñas variaciones del pH fisiológico cambiarán su carga total. Por debajo de un pH de 6, el
anillo imidazol está mayoritariamente protonado, con carga positiva. El anillo imidazol es
también Hidrocarburo aromático.
Candy Marisol Colaj Capriel
5to Bachillerato en Educación
Clave:4
|
|







No hay comentarios.:
Publicar un comentario